Für die Behandlung der bösartigen Krebserkrankung Multiples Myelom haben CAR-T-Immunzellen ein großes Potenzial. Doch im Lauf der Therapie kann es zu folgenschweren Resistenzen kommen. Wie das passiert, ist jetzt bekannt.
Das Multiple Myelom ist eine bösartige Krebserkrankung des Knochenmarks. Eine große Hoffnung im Kampf gegen die bislang unheilbare Krankheit ruht auf neuen Immuntherapien, insbesondere auf der Behandlung mit CAR-T-Zellen.
T-Zellen sind weiße Blutkörperchen, die der Immunabwehr dienen. In ihrem natürlichen Zustand sind sie gegenüber Tumorzellen weitgehend „blind“. Jedoch können sie durch gentechnologische Veränderungen in die Lage versetzt werden, als CAR-T-Zellen spezifische Ziel-Antigene auf der Tumoroberfläche zu erkennen und die Krebszellen im Anschluss zu vernichten.
Folgenschwerer Rückfall bei Myelom-Patienten
Am Universitätsklinikum Würzburg (UKW) wurde unter Leitung von Professor Hermann Einsele, dem Direktor der Medizinischen Klinik II, Ende 2018 im Rahmen einer Studie erstmals ein intensiv vorbehandelter Myelom-Patient mit schlechter Prognose mit CAR-T-Zellen therapiert.
Die Behandlung wirkte geradezu spektakulär: Innerhalb kürzester Zeit schien das Knochenmark von Tumorzellen befreit zu sein. Auch die Myelom-Indikatoren im Blut des Patienten fielen unter die Nachweisgrenze. Doch dies war nur ein Sieg auf Zeit. Nach fünf Monaten kam es zu einem massiven Rückfall: Das Knochenmark war erneut mit Myelom-Zellen geflutet, der Patient starb nach wenigen Wochen.
Ziel-Antigen ging verloren
Was war geschehen? Forschende der Medizinischen Klinik II und des Würzburger Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) machten sich auf die Suche nach den Ursachen dieses Verlaufs. Sie entdeckten einen bedeutenden Resistenzmechanismus und stellten ihn in der Fachzeitschrift Nature Medicine vor.
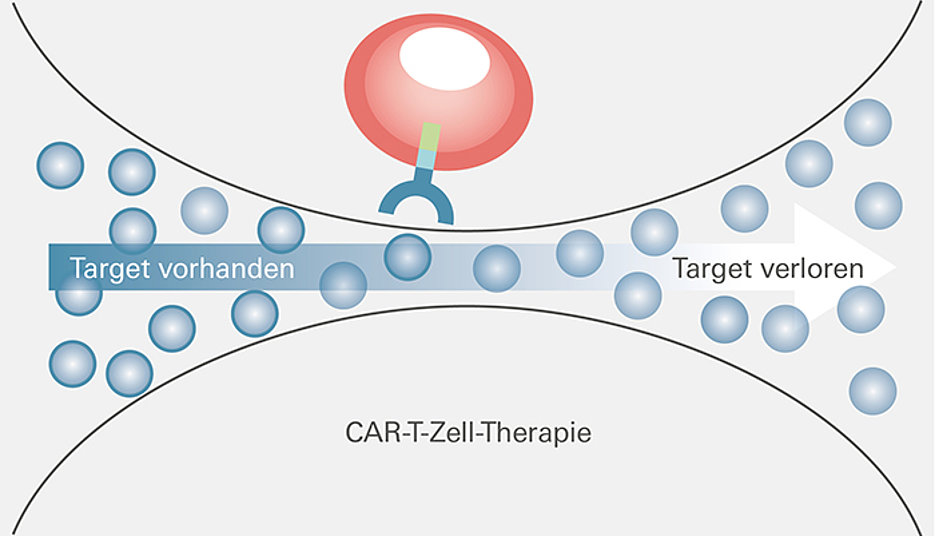
Eine Schlüsselrolle bei der Resistenz spielt BCMA. Dieses Antigen auf der Oberfläche von Myelom-Zellen war die entscheidende Zielstruktur der CAR-T-Zell-Therapie. „Wir haben zum Zeitpunkt des Rückfalls die Tumorzellen des Patienten untersucht und mussten feststellen, dass BCMA nun vollkommen fehlte“, berichtet Dr. Leo Rasche. Der Oberarzt der Medizinischen Klinik II ist der Initiator der Studie.
Genetische Variante profitiert vom Selektionsdruck
Um dem zunächst unerklärlichen Verlust des Antigens auf die Spur zu kommen, analysierten Forschende des HIRI Tausende der fraglichen Myelom-Zellen. „Bei den Krebszellen, die während des Rückfalls neu entstanden, fehlte der Genabschnitt, der den Code für BCMA enthält“, berichtet Dr. Emmanuel Saliba, Leiter der Einzelzellanalyse am HIRI.
Dahinter steckt nach Auffassung der Forschenden eine durch die CAR-T-Zell-Therapie hervorgerufene Selektion. Dr. Rasche erläutert: „Neben der riesigen Mehrheit der Myelom-Zellen mit BCMA gab es wahrscheinlich schon vor der Behandlung mit CAR-T-Zellen vereinzelt genetische Varianten ohne BCMA. Während die Zellen mit BCMA erfolgreich aufgespürt und eliminiert wurden, hatten die verbleibenden Zellen ohne BCMA einen so hohen Überlebensvorteil, dass sie sich in der Folge sprunghaft ausbreiten konnten.“
CAR-T-Zell-Therapien nicht nur auf ein Antigen richten
Diese Erkenntnis kann sich auf die Gestaltung künftiger CAR-T-Zell-Therapien auswirken. „Vieles spricht dafür, dass man mit CAR-T-Zellen nicht nur gegen ein spezifisches Antigen feuern sollte, sondern zwei oder sogar drei Ziele gleichzeitig adressieren muss“, sagt Dr. Rasche.
Technisch sei das möglich: Man könne einem Patienten zwei CAR-T-Zell-Produkte gleichzeitig geben. Oder man könne multispezifische CAR-T-Zellen einsetzen, die an ihrer Oberfläche mit mehreren Antigen-Rezeptoren ausgestattet sind. „Dadurch würde man den Selektionsdruck verteilen. Die Wahrscheinlichkeit, dass Tumorzellen überleben, würde bedeutend kleiner“, sagt der Internist.
Professor Einsele ergänzt: „Die Aktivität der CAR-T-Zellen ist beeindruckend. Umso wichtiger ist es, die Resistenzmechanismen noch besser zu verstehen, um diese zukunftsweisende Therapie weiter zu verbessern. Die Einzelzell-RNA-Sequenzierung hat sich dabei als ideales Screeningtool erwiesen.“
Professor Jörg Vogel, geschäftsführender Direktor des HIRI: „Wir sind stolz darauf, mit unseren RNA-Technologien weltweit eine Vorreiterrolle einzunehmen und unser Knowhow auch für die hiesige klinische Forschung bereitzustellen. Am HIRI ist es uns ein wichtiges Anliegen, mit unseren Technologien die biomedizinische Forschung am Wissenschaftsstandort Würzburg zu stärken.“
Genetisch vorbelastete Risikogruppe?
Neben dem Würzburger Patienten sind laut Dr. Rasche bislang zwei weitere ähnliche Resistenzfälle bei Myelom-Patienten in den USA und Kanada bekannt. Dennoch könne man die Häufigkeit derzeit noch nicht beurteilen.
„Im Moment ist offen, ob dieser Mechanismus bei allen Erkrankten auftritt oder nur bei einer bestimmten Gruppe“, so Rasche. In diesem Zusammenhang ist eine weitere Beobachtung der Würzburger Forschenden interessant: Bei etwa sechs Prozent aller Myelom-Patientinnen und -Patienten fehlt – auch ohne CAR-T-Zell-Therapie – eines der ansonsten doppelt vorhandenen BCMA-kodierenden Gene. Das könnte ein erhöhtes Risiko für den beschriebenen Resistenzmechanismus anzeigen.
Publikation
Da Vià, M.C., Dietrich, O., Truger, M., Arampatzi, P., Duell, J., Heidemeier, A., Zhou, X., Danhof, S., Kraus, S., Chatterjee, M., Meggendorfer, M., Twardziok, S., Goebeler, M., Topp, M.S., Hudecek, M., Prommersberger, S., Hege, K., Kaiser, S., Fuhr, V., Weinhold, N., Rosenwald, A., Erhard, F., Haferlach, C., Einsele, H., Kortüm K. M., Saliba, A., Rasche, L., Homozygous BCMA gene deletion in response to anti-BCMA CAR T cells in a patient with multiple myeloma. Nat Med (2021). https://doi.org/10.1038/s41591-021-01245-5