Studie vom Uniklinikum Würzburg liefert erstmals ein Maß, um die Knochenregeneration beim Multiplen Myelom zu beurteilen. Die Vermessung der Läsionsgröße ist ein verlässlicher Parameter für die Definition des Endpunktes in geplanter Folgestudie zur Bewegungstherapie.
Würzburg. Das Multiple Myelom zählt zu den häufigsten Tumoren im Knochen und Knochenmark. Dauerhaft geheilt werden kann die Krebserkrankung noch nicht. Und selbst wenn die Tumorzellen mit modernen Therapien abgeräumt wurden, bleiben in der Regel Löcher im Knochen, die zu Schmerzen, Frakturen und im schlimmsten Fall zu einer Querschnittslähmung führen können. Am Uniklinikum Würzburg (UKW) wurde nun erstmals wissenschaftlich analysiert, ob und in welchem Maß sich die Knochen während einer standardisierten Induktionstherapie, also in der ersten intensiven Behandlungsphase, regenerieren.
Nach Induktionstherapie: Läsionen verkleinern sich um 22 Prozent, Trabekel remineralisiert
Nach sechs Zyklen mit dem Anti-SLAM7-Antikörper Elotuzumab in Kombination mit dem Proteasom-Inhibitor Carfilzomib, dem Immunmodulator Lenalidomid und Kortison Dexmethason (kurz E-KRd) hat sich die Größe der Löcher im Schnitt um 22 Prozent verringert. Ferner war auf den Röntgenbildern eine deutliche Remineralisierung des Trabekels, also des Knocheninneren, zu erkennen.
„Das ist die gute Botschaft: Eine Knochenregeneration findet statt. Es ist möglich, das Innere des Knochens wiederaufzubauen“, freut sich Prof. Dr. Franziska Jundt. Die Oberärztin der Medizinischen Klinik und Poliklinik II am UKW hat selbst nicht mit so einem positiven Ergebnis gerechnet, dass man mit modernen Therapien 22 Prozent Regeneration erreichen kann. Aber die Lücke zu 100 Prozent sei noch zu groß. „Deshalb benötigen wir unbedingt neue Therapieideen, um den Knochenaufbau anzustoßen.“
Impact-Training: Springen und stampfen für stärkere Knochen
Einen Ansatzpunkt verfolgt Franziska Jundt derzeit mit einem Impact-Training. Durch gezieltes und regelmäßiges Springen und Stampfen soll das muskuloskelettale System stimuliert werden, sodass sich die Knochendichte erhöhen, die Mobilität verbessern und Frakturen vorgebeugt werden könnte. „Wir streben mindestens das doppelte an Knochenmineralisation an“, so die Hämatoonkologin. In einer Machbarkeitsstudie (MIMM) hat Franziska Jundt gerade geprüft, ob die Bewegungstherapie, die in Zusammenarbeit mit Freerk Baumann, Professor für onkologische Bewegungswissenschaften an der Uniklinik Köln, entwickelt wurde, den Myelom-Patientinnen und Patienten zugemutet werden kann. „Die Daten werden gerade noch ausgewertet, aber wir haben tolle Effekte hinsichtlich der Leistungsfähigkeit und Lebensqualität bei unseren Probandinnen und Probanden beobachtet, und das Training unter medizinischer Anleitung kann unter Umständen sogar während einer Chemotherapie laufen“, berichtet Franziska Jundt.
Die Wirksamkeit des Impact-Trainings soll nun in einer größer angelegten Studie in Würzburg, aber auch in Essen und Köln getestet werden. Für die Zielgröße galt es einen primären Endpunkt zu formulieren. Mit welchem Parameter kann die Knochenregeneration quantitativ und qualitativ beurteilt werden?
Vermessung der Läsionsgröße ist verlässlicher Parameter
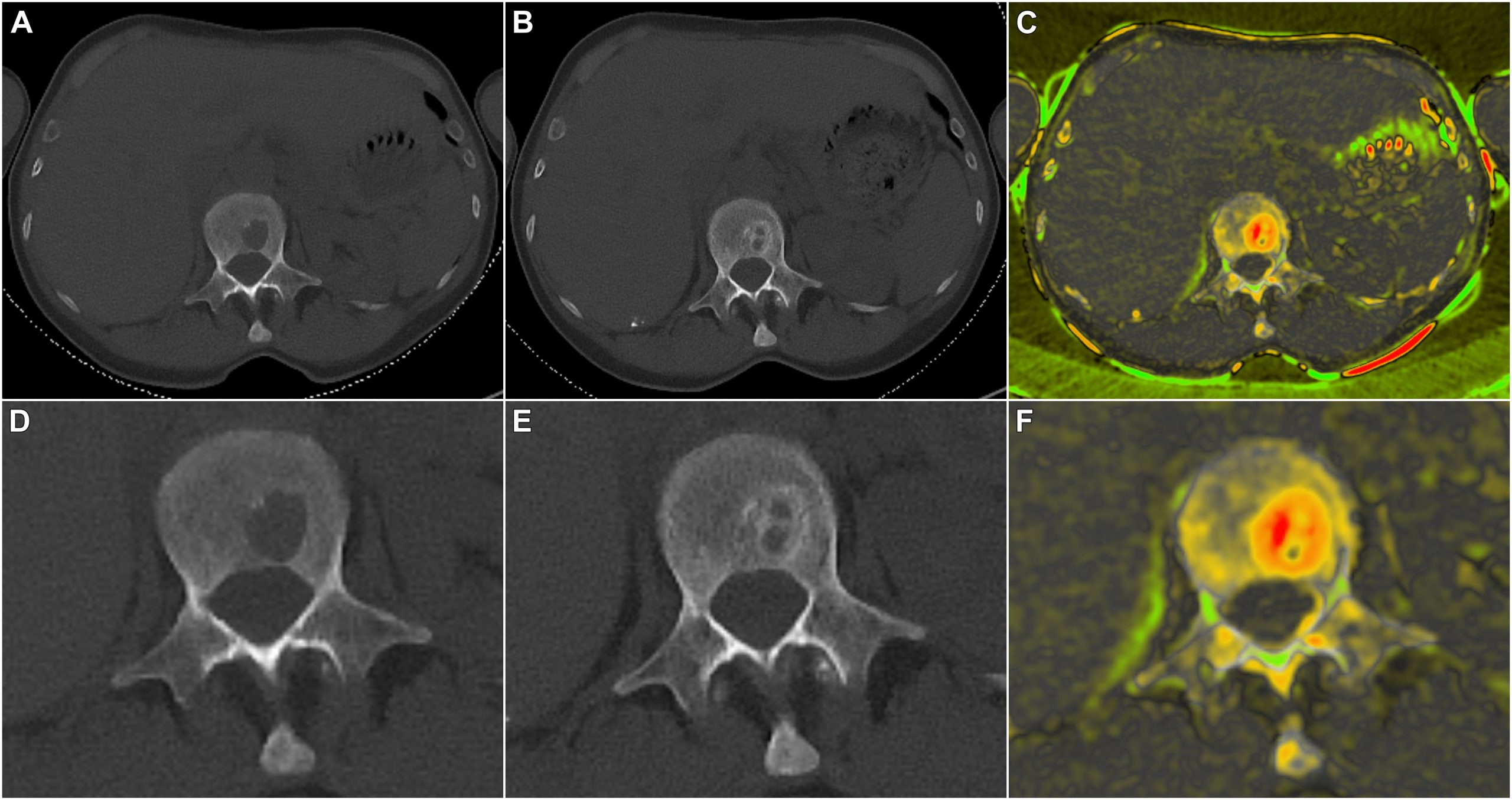
Am Uniklinikum Würzburg haben die Radiologen Dr. Jan Peter Grunz und Privatdozent Dr. Andreas Kunz unabhängig voneinander Röntgenbilder beurteilt, die von insgesamt 20 Patientinnen und Patienten mit einem neu diagnostizierten Multiplen Myelom vor und nach der standardisierten E-KRd-Therapie mittels Computertomografie erstellt wurden. „Die erste Herausforderung war das Finden und Messen der Läsionen zu beiden Zeitpunkten“, kommentiert Jan-Peter Grunz, der die Ergebnisse als Erstautor im Fachjournal Cancers publiziert hat. Insgesamt sind den Radiologen 108 Läsionen aufgefallen, wovon 94 von beiden entdeckt wurden, 14 nur von jeweils einem.
„Unterm Strich haben wir in der Studie gezeigt, dass wir die Läsionen mit einer Standardabweichung von 1,2 Millimetern verlässlich erfassen und messen können“, resümiert Jan-Peter Grunz. Gemeinsam mit dem Bioinformatiker Dr. Dirk Hasenclever aus Leipzig haben die Radiologen aber nicht nur ein quantifizierbares Maß geliefert, welches man auf andere Studien übertragen kann, sondern auch den Remineralisierungsprozess qualitativ dargestellt. „Mit einer speziellen Farbkodierung konnten wir die Regeneration im inneren und äußeren Bereich der Knochen sichtbar machen“, erläutert Jan-Peter Grunz.
Knochenzellen aus der Lethargie holen
Welche Faktoren zusammenkommen müssen, um den knochenzersetzende Prozess umzukehren und einen vollständigen stabilen Knochenaufbau zu erreichen, sei noch unklar. „Die Tumorzellen haben die Knochenzellen so verändert, dass sie in einem lethargischen Zustand sind und keinen Knochenaufbau betreiben können. Diesen Zustand gilt es zu überwinden“, erörtert Franziska Jundt. Vielleicht löst die mechanische Stimulation durch das Sprung- und Stampftraining diese Bremse, vielleicht können neue Immuntherapien weitere Anstöße liefern, vielleicht muss zusätzlich ein Signalweg in den Knochenzellen beeinflusst werden.
Notch-Signalweg verantwortet Expression der extrazellulären Matrix
Ihre neuesten Erkenntnisse zum Notch-Signalweg hat Franziska Jundt gerade im Blood Cancer Journal publiziert. Der Notch-Signalweg sorgt nicht nur dafür, dass die Myelomzellen besser wachsen und weniger über den programmierten Zelltod zu Grunde gehen können, er ist auch dafür zuständig, dass die Tumorzellen die sie umgebende Matrix produzieren. „Das bedeutet, dass sich die Tumorzellen ihr Bett selber formen“, erklärt Franziska Jundt. „Und diese vom Tumor gebildeten Matrix-Faktoren sind relevant für das Überleben der Myelom-Patientinnen und Patienten. Die Expression bestimmter Matrix-Faktoren steht unmittelbar mit einem besseren oder schlechteren Überleben in Verbindung.“ Die Schwierigkeit besteht nun darin, den Notch-Signalweg in den Tumorzellen spezifisch zu blockieren, ohne zu viele negative Nebeneffekte auf gesunde Zellen.
Über das Multiple Myelom und Immuntherapien:
Das Multiple Myelom ist nach der Leukämie die zweithäufigste Blutkrebserkrankung, bei der es zu verschiedenen bösartigen Tumorherden im Knochenmark kommt. Der Begriff leitet sich vom Lateinischen „multiple“ für vielfach und dem Griechischen „myelos“ für Mark ab. Jedes Jahr erhalten allein in Deutschland rund 7.000 Menschen die Diagnose. Das Erkrankungsrisiko steigt in höherem Alter deutlich an. Bei den Betroffenen vermehren sich entartete Plasmazellen unkontrolliert und verdrängen die gesunden weißen Blutkörperchen, die für die Produktion von Antikörpern zuständig sind. Aufgrund des veränderten Immunität kommt es vermehrt zu Infektionen, die Knochenstruktur wird zerstört, Nerven und Organe werden geschädigt, die Betroffenen leiden unter Müdigkeit und Appetitlosigkeit. Dauerhaft geheilt werden kann diese Krebserkrankung noch nicht. Denn auch nach vermeintlich erfolgreicher Therapie müssen die Betroffenen immer mit einem Rezidiv rechnen. Mit einem besseren Verständnis der Evolution dieser entarteten Knochenmarkzellen könnten aber die Diagnose und Behandlung optimiert werden.
Als große Hoffnungsträger gelten Immuntherapien mit Antikörpern oder Gen-manipulierten T-Zellen, den so genannten CAR-T-Zellen. Das Universitätsklinikum Würzburg (UKW) spielt bei der Erforschung, Anwendung und Ausweitung dieses neuen Arzneimittelprinzips eine international bedeutende Rolle. So wird in Würzburg das größte Myelom-Programm in Europa mit vielem klinischen Studien und Begleitforschung zu den neuesten Therapieformen wie CAR-T-Zellen und verschiedenen T-Zell-aktivierenden (bispezifischen) Antikörpern angeboten.
Bild:
Darstellung des Therapieansprechens bei einer 62-jährigen Patientin mit multiplem Myelom (IgG kappa, R-ISS I). Die Baseline-CT zeigt einen Knochendefekt im ersten Lendenwirbel (A/D) mit trabekulärer Remineralisierung nach sechs Zyklen E-KRd (B/E). Eine farbkodierte Subtraktionskarte zeigt das Ausmaß der Remineralisierung in verschiedenen Teilen der Läsion (C/F). Obere Reihe: Standardansicht. Untere Reihe: Vergrößerung.
©Jan-Peter Grunz / MDPI (doi.org/10.3390/cancers15154008)