Translationsgruppen 2024
Translationsgruppe Waidhauser
Projekttitel: SARIFA T³riangle
Hauptantragstellerin: Dr. med. Johanna Waidhauser (Universitätsklinikum Augsburg)
Beteiligte Standorte: TUM Klinikum München
Der kürzlich durch unsere Studiengruppe definierte neue histologische Biomarker „SARIFA“ (Stroma AReactive Invasion Front Areas) beschreibt einen direkten Kontakt von Tumorzellen zu umgebenden Fettzellen (Adipozyten), ohne dass es zu einer bindegewebigen Begleitreaktion kommt. Dieser einfach zu bestimmende Biomarker zeigte sich als hochrelevanter Prognosemarker für verschiedene Tumorarten und scheint z.B. beim Magenkarzinom geeignet, Therapieentscheidungen im Hinblick auf zusätzliche Chemotherapie nach Operation zu begründen. Dabei erfüllt er wesentliche Voraussetzungen für eine breite Anwendung in der klinischen Routine: keine Notwendigkeit zusätzlicher Färbungen oder Untersuchungen, hohe Reproduzierbarkeit zwischen Untersuchern, geringer Lernaufwand und eine schnelle Anwendung. Erste weiterführende Untersuchungen unserer Arbeitsgruppe beschäftigten sich mit den zu Grunde liegenden Mechanismen und konnten zeigen, dass immunologische Veränderungen eine Rolle zu spielen scheinen genauso wie Veränderungen im Fettstoffwechsel der Tumorzellen. Das Ziel dieser translationalen Studie ist es, in einem dreiteilig aufgebauten, interdisziplinären Konzept SARIFA in seiner biologischen Funktion als prognostischer Biomarker besser zur verstehen und in die klinische Forschung als therapeutisches Target zu überführen.
Translationsgruppe Blazquez
Projekttitel: Translationsgruppe für Drug Repurposing und Target-Identifizierung bei schwer zu behandelnden Krebserkrankungen
Hauptantragstellerin: Dr. Raquel Blazquez (Universitätsklinikum Regensburg)
Beteiligte Standorte: FAU Erlangen-Nürnberg, Julius-Maximilians-Universität Würzburg
Die Translationsgruppe BZKF-TLG-PRe-Drug (Preclinical drug repurposing and target identifi-cation in hard-to-treat cancers) zielt darauf ab, im Rahmen des BZKF eine Plattform für Drug Repurposing und Target-Identifizierung zu etablieren, die eine schnelle Translation bereits zu-gelassener Medikamente in die klinische Phase I ermöglicht. Zu diesem Zweck arbeitet die BZKF-TLG-PRe-Drug an einer präklinischen Pilotstudie für dreifach negativen Brustkrebs (TNBC) und Lungenadenokarzinome (LUAC) um Ferroptose-induzierende Medikamente zu identifizieren (PRe-Ferro 001). Im Vergleich zu den klassischen Ansätzen der Arzneimittelentwicklung senkt das Repurposing von Arzneimitteln die Kosten und vor allem die Zeit, die erforderlich ist, um einen Wirkstoff in die Klinik zu bringen, erheblich. Darüber hinaus wurden diese Medikamente medizinisch und chemisch optimiert und haben eine gut charakterisierte Pharmakokinetik. Aus diesem Grund konzentriert sich die Gruppe auf von der FDA zugelassene Wirkstoffe, die für die Krebsbehandlung umgewidmet werden können und den Wirkmechanismus der Ferroptoseinduktion, eine neu beschriebene Form des Zelltods, die besonders bei hochplastischen (mesenchymalen) und therapeutisch anspruchsvollen Tumorzellen wirksam ist. In einer Vorstudie haben wir Artesunat, ein Anti-Malaria-Mittel, als potenten Ferroptose-Induktor identifiziert. Ziel ist die Erarbeitung einer prädiktive Markersignatur und deren Validierung in präklinischen Proben. Die Expression ausgewählter prädiktiver Marker wird in einer Reihe von TNBC- und LUAC-Proben in Zusammenarbeit mit Pathologen vom BZKF-Netzwerk Molecular Tumor Board and Early Clinical Trial Unit (MTB/ECTU) und der BZKF-Arbeitsgruppe “Biobank” evaluiert und dient der Entwicklung eines Classifiers für die Ferroptose-Sensitivität.
Translationsgruppe Bosserhoff
Projekttitel: Untersuchung der kombinierten Wirkung von Inhibitoren des Moleküls MIA
und Immuncheckpointinhibitoren zur Therapie des malignen Melanoms
Hauptantragstellerin: Prof. Dr. rer. nat. Anja Katrin Bosserhoff (FAU Erlangen-Nürnberg)
Das Melanom ist ein hochgradig bösartiger Tumor, der aus Pigmentzellen hervorgeht. Der gefährlichste Aspekt dieses Tumors ist seine Fähigkeit, früh zu metastasieren. Dabei können die Melanomzellen über wichtige Kontrollpunkte (Checkpoints) das Immunsystems so manipulieren, dass sie den Angriffen des Immunsystems entgehen. Um diesen Mechanismus auszuschalten, werden sogenannte (Immun)Checkpoint-Inhibitoren zur Melanomtherapie eingesetzt. Ihre Wirkung ist jedoch meist nicht dauerhaft, da die Tumorzellen Resistenzmechanismen entwickeln, und teils auch mit erheblichen Nebenwirkungen verbunden. Das Protein MIA wird von Melanomzellen in großer Menge gebildet, nicht jedoch von normalen Pigmentzellen. Die Freisetzung von MIA ermöglicht es der Tumorzelle, sich von der Umgebung abzulösen, dadurch in andere Gewebe einzuwandern und dort Metastasen zu bilden. Zudem unterdrückt MIA durch Bindung an bestimmte Oberflächenmoleküle auf Immunzellen das Immunsystem und damit eine natürliche Immunantwort gegen den Tumor. MIA erscheint auch als vielversprechendes therapeutisches Target. Der Gruppe ist es gelungen, den molekularen Mechanismus der MIA-Wirkung auf Melanomzellen aufzudecken und basierend hierauf Substanzen zu entwickeln, mit denen MIA effektiv inhibiert werden kann. In präklinischen Modellen konnte gezeigt werden, dass durch Applikation dieser neuen Substanzen eine signifikante Reduktion der Metastasierung und eine nahezu komplette Aufhebung der Immunsuppression induziert werden kann. In dem hier beantragten Projekt soll untersucht werden, ob durch die kombinierte Gabe von MIA-Inhibitoren das Ansprechen auf Immuncheckpoint- Inhibitoren verbessert werden kann. So soll die Basis für eine neuartige, effektive und verträgliche Therapie für die Behandlung von Melanompatienten geschaffen und deren klinische Anwendung dann im BZKF weiter vorangetrieben werden.
Translationsgruppe Subklewe
Projekttitel: CAR T Control – Understanding and Addressing Toxicities of CAR T-Cell Therapy
Antragstellerin: Prof. Dr. Marion Subklewe (LMU Klinikum München)
Beteiligte Standorte: Universitätsklinikum Erlangen
Mitglieder: PD Dr. med. Kai Rejeski, PD Dr. Fabian Müller, Prof. Dr. Frederik Graw, Prof. Dr. Louisa von Baumgarten, Prof. Dr. Nathalie Albert
Die Chimare Antigen Rezeptor T-Zelltherapie (CAR-T) hat die Therapielandschaft der fortgeschrittenen B-Zell Neoplasien maßgeblich verändert und wird nun auch für die Behandlung von soliden Tumoren und Autoimmunerkrankungen erprobt. Leider sind CAR-T assoziierte Nebenwirkungen, die oftmals Hand in Hand mit dem Therapieansprechen gehen, nicht selten langanhaltend und können zu signifikanten Einschränkungen der Lebensqualität führen. Im Rahmen des BZKF-Leuchtturms Zellulare Immuntherapien wurden bereits Strukturen für das prospektive Sammeln von klinisch annotierten Patientenproben (n>200 CAR Patienten) etabliert, die nun hoch-effizient für assoziierte translationale Begleitprojekte genutzt werden. Es werden die pathophysiologischen Zusammenhänge der wichtigsten Nebenwirkungen von modernen T-Zell basierten Immuntherapien exploriert. In dem umfassenden Arbeitsprogramm der Gruppe werden serologische und bildgebende Biomarker der Neurotoxizität analysiert und Interaktionen zwischen der systemischen Inflammation und der Hämatopoese untersucht. Darüber hinaus widmet sich die Gruppe den langfristigen Veränderungen des Immunsystems und deren Konsequenzen für die adaptive Immunität. Maschinelles Lernen wird genutzt um Toxizität und Therapieansprechen zu prädizieren. Die gewonnen Erkenntnisse werden unser pathophysiologisches Verständnis der besonderen Nebenwirkungen vertiefen und risikoadaptierte Interventionen für CAR T-Zelltherapien und anderen Zelltherapien ermöglichen.
Translationsgruppe Poeck
Projekttitel: TANGO – Unravel the power of microbial meTabolites As a Novel precision oncoloGy approachin CAR T cell treated patients
Antragsteller: Prof. Dr. Hendrik Poeck (Universitätsklinikum Regensburg)
Beteiligte Standorte: Universitätsklinikum Erlangen, LMU Klinikum München, TUM Klinikum München, Universitätsklinikum Würzburg
Die Zusammensetzung der Mikroorganismen im Menschen (sog. Mikrobiom) ist für eine Vielzahl physiologischer Prozesse entscheidend. Krebs-Immuntherapien wie die CAR T-Zelltherapie werden durch das Mikrobiom maßgeblich moduliert. Dies ermöglicht die Entwicklung von neuartigen Mikrobiom-adressierenden Interventionen, um bisherige Limitationen von adaptiven Zelltherapien zu überwinden. In zwei Arbeitspaketen wird die TANGO-Initiative unter Mitwirkung von fünf im BZKF und anderen bayerischen und europäischen Netzwerken verbundenen Standorten das mikrobielle Metabolom von Patienten bezüglich Assoziation mit Effektivität und Nebenwirkungen der CAR T-Zelltherapie untersuchen. Nachfolgend werden die dabei gewonnenen Erkenntnisse revers in etablierte präklinische Modelle translatiert, um die Erkenntnisse mechanistisch greifbar zu machen. Dabei werden wir Mischungen reiner Metabolite und Stuhl von Donoren basierend auf deren „Metabolitprofil“ (Präzisions Fäkale Mikrobiom Transplantation, engl. „Precision FMT“) verwenden. Die Erkenntnisse wiederum sollen Basis für eine multizentrische „Precision FMT“ Studie innerhalb des NCT/BZKF/DKTK-Netzwerks für CAR T-Zell-Patienten mit anhand von Biomarkern nachgewiesener “intestinaler Dysbiose” sein. Die kürzliche Etablierung eines akkreditierten FMT-Labors in Regensburg zur Herstellung eines solchen Precision FMT-Produkts stellt eine einzigarte Voraussetzung für dieses Projekt dar.
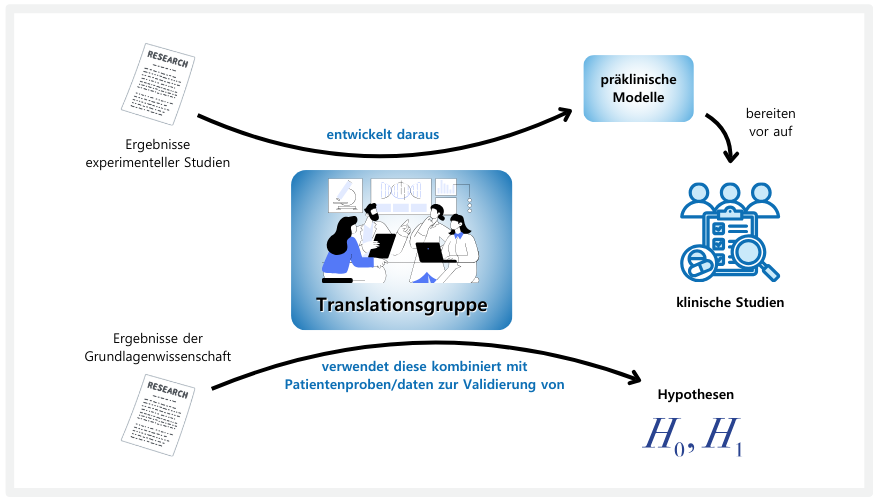
Besonderes Augenmerk wird auf die Entwicklung von Vorhersagemarkern (Biomarker) gelegt. Mit derartigen neuen Biomarkern wird es möglich sein, weit besser als heute das Ansprechen auf Therapieformen vorherzubestimmen. In der Folge werden unnötige Therapien und Nebenwirkungen vermeidbar sein und Ressourcen können effizienter genutzt werden.
Bewerbungsvoraussetzung ist unter anderem die Ansiedlung des Forschungsprojekts im BZKF-Netzwerk an einer der bayerischen Universitäten und/oder an einer der bayerischen Uniklinika, bzw. deren Comprehensive Cancer Center. Weitere Informationen finden Sie hier.


