Zweithäufigste hämatologische Malignität
Studiengruppe Multiples Myelom
Deutsche Studiengruppe Multiples Myelom – Aktuelle und zukünftige Studienprotokolle in der Erstlinientherapie.
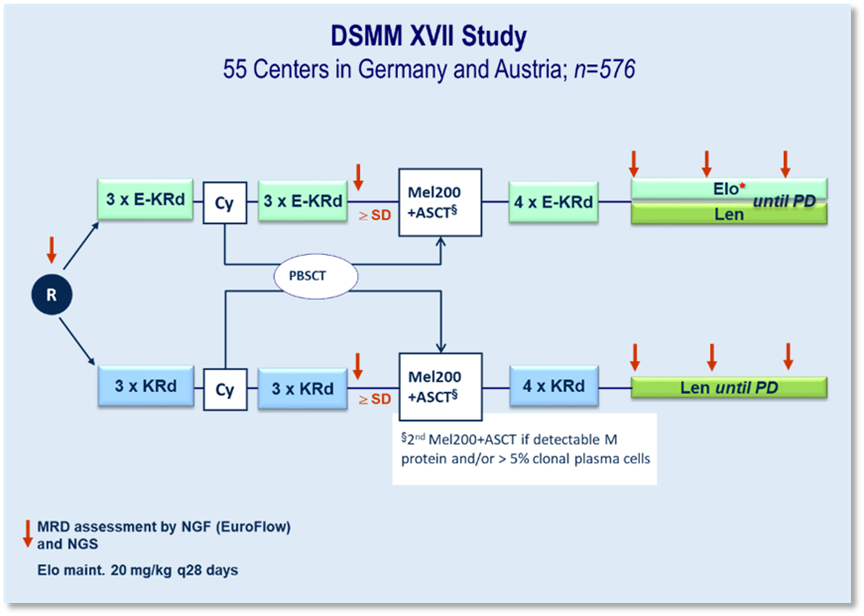
DSMM XVII
In der DSMM XVII-Studie wird erstmals in Phase 3 eine spezifische Immuntherapie von unserer Studiengruppe getestet. Zum Einsatz kommt der gegen SLAMF7 gerichtete, humanisierte IgG4-Antikörper Elotuzumab (Elo). Diese Substanz wird in der Induktion und Konsolidierung zusammen mit Carfilzomib (K), Lenalidomid (R) und Dexamethason (d) gegen KRd untersucht. In der Erhaltung wird Elo-R gegen R geprüft.
Kerncharakteristika:
» Internationale Phase 3-Erstlinienstudie an 45 deutschen und zehn österreichischen Zentren
» 576 Patienten (LPFV 10/2022)
Der gute Abschluss einer großen Bundesländerübergreifenden Inspektion durch die Behörden in den Jahren 2022/2023 bestätigt die Datenintegrität und die Durchführung der Studien nach hohen Standards.
Erste Ergebnisse des Co primären Endpunktes „Rate der Patienten, die eine VGPR oder besser erreichen und MRD-negativ sind (gemessen mittels Next-Generation-Flow mit einer Sensitivität von 10⁻⁵) nach sechs Zyklen der Induktionsbehandlung“, wurden auf dem ASCO 2003 veröffentlicht. Diese Phase-III-Studie zeigte, dass die Hinzufügung von Elotuzumab zu KRd (Carfilzomib, Lenalidomid und Dexamethason) die Ergebnisse der Induktionstherapie bei transplantationsfähigen Patienten mit neu diagnostiziertem Multiplem Myelom verbesserte, insbesondere hinsichtlich der Ansprechrate und der negativen minimalen Resterkrankung (MRD).
Anfang des Jahres konnte der nächste wichtige Co-Primäre Endpunkt „das progressionsfreie Überleben (PFS) nach drei Jahren seit der Randomisierung, ausgewertet werden. Dabei zeigte sich ein statistisch nicht signifikanter Trend zugunsten eines besseren 36-Monate-PFS für Elo-KRd.
DSMM XIX
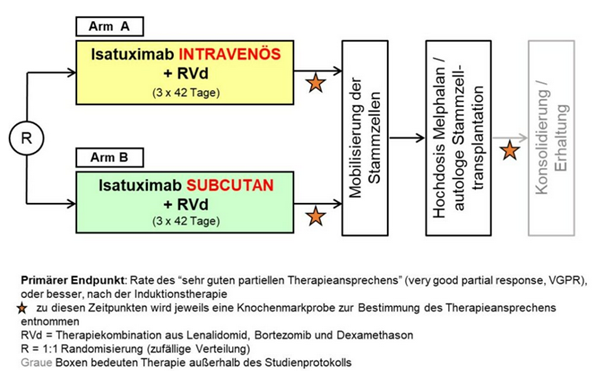
Randomisierte Phase 3-Nichtunterlegenheitsstudie zur Untersuchung einer Induktionstherapie mit Lenalidomid, Bortezomib und Dexamethason mit intravenöser oder subkutaner Gabe von Isatuximab für Patienten mit neudiagnostiziertem Multiplem Myelom, die für eine Hochdosis-Chemotherapie mit nachfolgender autologer Stammzelltransplantation geeignet sind.
Die GMMG-HD8/DSMM XIX-Studie ist eine Nachfolgestudie der GMMG-HD7, welche ihrerseits zum Ziel hat, den Therapieerfolg bei neudiagnostizierten Patienten mit und ohne Hinzunahme des monoklonalen anti-CD38-Antikörpers Isatuximab zur RVd-Kombination (Lenalidomid, Bortezomib, Dexamethason) zu vergleichen.
Im Gegensatz dazu bekommen in der GMMG-HD8/DSMM XIX-Studie, die im März 2023 gestartet ist, alle Patienten (n=514) das Studienmedikament Isatuximab gemeinsam mit dem RVd-Therapieschema. Der primäre Endpunkt der Studie ist die Nicht-Unterlegenheit der subkutanen Isatuximab-Gabe gegenüber der intravenösen, die bisher für die Behandlung des refraktären Myeloms zugelassen ist, in Bezug auf Raten des Therapieansprechens („very good partial response or better“). Ein weiterer Endpunkt der Studie ist der Vergleich der Lebensqualität in den beiden Studienarmen mithilfe von PRO-Fragebögen.
Die Patienten werden auf die zwei Arme randomisiert, und nach R-ISS-Stadium und nach Körpergewicht stratifiziert. Eine Besonderheit der Studie ist die Anwendung eines Medizinprodukts – eines mechanischen Injektors, mit dem die Patienten Isatuximab subkutan verabreicht bekommen, weshalb die GMMG-HD8/DSMM XIX eine kombinierte AMG/MPDG-Studie ist. Die GMMG-HD8/DSMM XIX endet im Gegensatz zur GMMG-HD7 bereits nach der ersten Hochdosistherapie/Stammzelltransplantation, eine Erhaltungstherapie findet außerhalb der Studie statt.
GMMG-HD8/DSMM XIX ist die erste gemeinsame Phase III-Studie mit der Deutschen Studiengruppe Multiples Myelom (DSMM). Außerdem wird die Studie in zwei Ländern, Deutschland und Österreich, durchgeführt. Zunächst ist der Studienstart nur in Deutschland erfolgt, seit Ende des Jahres 2023 kommen sukzessive Prüfstellen in Österreich dazu. Im März dieses Jahres konnte die Rekrutierung von 514 Studienpatienten erfolgreich abgeschlossen werden.
Studiendesign: Prospektive, multizentrische, randomisierte, unverblindete Phase-III-Studie zur Erstlinientherapie von transplantierbaren MM-Patienten bis zu 70 Jahren
DSMM XVIII
Phase III-Studie zur Untersuchung einer Erhaltungstherapie mit Iberdomid versus Iberdomid plus s.c. Isatuximab nach autologer hämatopoetischer Blutstammzelltransplantation für Patienten mit neudiagnostiziertem Multiplem Myelom.
Dies GMMG-HD9/ DSMMXVIII-Studie ist als Anschlussbehandlung (Erhaltungstherapie) der GMMG-HD8/DSMM XIX-Studie konzipiert, die Lenalidomid, Bortezomib und Dexamethason mit dem monoklonalen Antikörper Isatuximab (Sarclisa®) in einem Induktionstherapie-Schema kombiniert. Die GMMG-HD9/DSMM XVIII-Studie richtet sich an Patienten, die diese Induktionstherapie, gefolgt von einer Hochdosistherapie und autologer Stammzelltransplantation, erfolgreich abgeschlossen haben und mindestens ein Teilansprechen auf die Behandlung gezeigt haben.
In dieser Studie wird in beiden Armen das Medikament Iberdomid eingesetzt, wobei Arm B zusätzlich die subkutane Gabe von Isatuximab erhält. Iberdomid wirkt ähnlich wie Lenalidomid, jedoch deuten erste Studienergebnisse darauf hin, dass es eine bessere Verträglichkeit und Wirksamkeit aufweist, insbesondere bei Krebszellen, die gegen Lenalidomid resistent geworden sind. Die Kombination mit Isatuximab könnte zu einer stärkeren Wirksamkeit der Therapie und einer verlängerten Zeit bis zum Rückfall der Erkrankung führen.
Ziel der Studie ist es zu prüfen, ob die Kombination von Iberdomid und Isatuximab (Arm B) im Vergleich zu Iberdomid allein (Arm A) überlegen ist.
DSMMXX
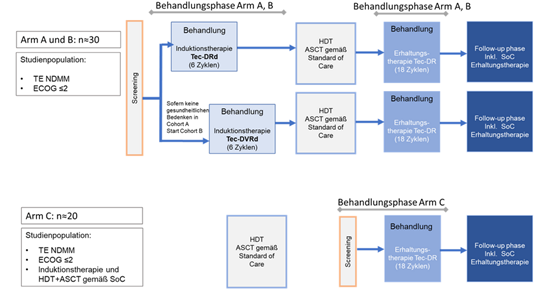
Phase-2-Studie zur Bewertung der Sicherheit und Wirksamkeit von Teclistamab in Kombination mit Daratumumab, Lenalidomid und Dexamethason mit und ohne Bortezomib als Induktionstherapie und Teclistamab in Kombination mit Daratumumab und Lenalidomid als Erhaltungstherapie bei transplantationsgeeigneten Patienten mit neu diagnostiziertem Multiplem Myelom.
Bei der GMMG-HD10/DSMM XX-Studie, die im November 2022 gestartet ist, handelt es sich um eine gemeinsame Phase 2-Studie der GMMG mit der Deutschen Studiengruppe Multiples Myelom (DSMM), in der eine Fünffach-Kombination in der Induktionstherapie geprüft wird. Eine Neuerung der Studie ist die Hinzunahme eines zweiten Antikörpers, Teclistamab, zu der Kombination aus Daratumumab (Dara), Lenalidomid (R), Bortezomib (V) und Dexamethason (d). Teclistamab (Tec) ist ein bispezifischer Antikörper, der zum Einen an den CD3-Rezeptorkomplex auf der Oberfläche von T-Zellen, und zum Anderen an das Protein BCMA (B-cell maturation antigen) auf der Oberfläche von Myelomzellen bindet. Die Bindung an den CD3-Komplex führt zur Aktivierung der T-Zelle, die daraufhin die am anderen Arm des Antikörpers gebundene Myelomzelle abtötet. Wegen seiner Fähigkeit, T-Zellen „einzufangen“, wird Teclistamab als ein T-cell engager bezeichnet.
Das Studiendesign gliedert sich in drei Studienarme, wobei Arm A und B eine Induktionstherapie mit Tec-Dara-Rd (Arm A) oder Tec-Dara-VRd (Arm B) erhalten. Nach einer Hochdosis-Chemotherapie gefolgt von einer autologen Stammzelltransplantation (HDT+ASCT) gemäß Standard of Care wird eine Erhaltungstherapie mit Tec-Dara-R in Arm A und B durchgeführt.
Arm C untersucht eine Erhaltungstherapie mit Tec-Dara-R im Anschluss an eine gemäß SOC durchgeführte Induktions-, HDT+ASCT und gegebenenfalls Konsolidierungstherapie
Für die Arme A und B sind ca. n=30, für Arm C n=20 Teilnehmer vorgesehen.
Primäres Studienziel für die Arme A und B ist die Bestimmung der Sicherheit und Verträglichkeit von Teclistamab in Kombination mit Dara-Rd oder Dara-VRd als Induktionstherapie, sowie Teclistamab in Kombination mit Dara-R als Erhaltungstherapie nach Standard- HDT+ASCT bei neu diagnostizierten Patienten. Bestimmt werden die Häufigkeit und Schwere von auftretenden unerwünschten Ereignissen. Die sekundären Ziele umfassen unter anderem die Bestimmung der Wirksamkeit der jeweiligen Kombinationstherapie, Raten der MRD-Negativität, das Therapieansprechen und das progressionsfreie Überleben.
Die Behandlungsdauer der Induktionsphase beträgt 6 Zyklen (à 28 Tage). Aus Sicherheitserwägungen wird zunächst mit Arm A (Tec-Dara-Rd) begonnen. Sofern die Patientensicherheit gewährleistet ist, werden Patienten in Arm B (Tec-Dara-VRd) eingeschlossen, in dem eine zusätzliche Bortezomib-Behandlung vorgesehen ist.
Nach 6 Zyklen Induktionstherapie schließt sich eine Hochdosis-Chemotherapie + ASCT gemäß Standard of Care an. Nach Abschluss der ASCT beginnt die Erhaltungsphase der Studie unter Tec-Dara-R mit einer Dauer von 18 Zyklen.
Studienarm C beginnt mit dem Screening nach abgeschlossener Hochdosis-Chemotherapie + ASCT gemäß Standard of Care. Die Behandlung erfolgt genauso wie in Arm A und B mit Tec-Dara-R als Erhaltungstherapie für 18 Zyklen.
Die Follow-Up Phase wird nach „end of treatment“ (EOT) oder 18 Zyklen Erhaltungstherapie erreicht. Während des Follow-ups sind weitere Therapien nach Entscheidung des Prüfarztes und gemäß lokaler Standards erlaubt.
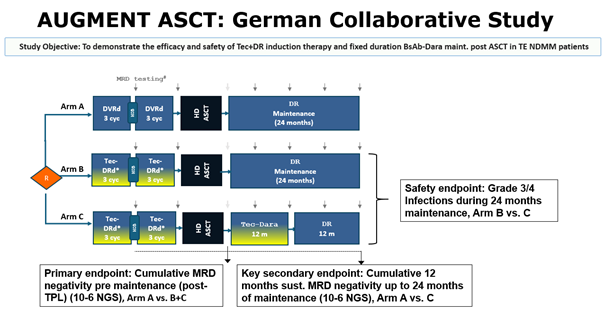
AugMMent Study
AugMMenTE is a collaborative study between the “Deutsche Studiengruppe Multiples Myelom” (DSMM), the German-speaking Myeloma Multicenter Group (GMMG) (study sponsor University Hospital Heidelberg) and Johnson&Johnson Innovative Medicine (operational entity Medical Affairs Germany). AugMMenTE is an open-label, randomized interventional multicenter phase 3 clinical trial to assess the efficacy and safety of Tec+DR induction therapy and fixed duration Tec-D maintenance post autologous stem cell transplantation (ASCT) in transplant-eligible newly diagnosed Multiple Myeloma (TE NDMM) patients compared to the standard-of-care (SOC) PERSEUS regimen.
CMMC-Anima-2 Studie
Circulating Multiple Myeloma Cells (CMMCs) Assay as a Non-Invasive tool for Minimal Residual Disease (MRD) Assessment in peripheral blood: A comparative study with bone marrow MRD
Acronym: CMMC-ANIMA - 02
Principal Investigator: Prof. Dr. Hermann Einsele (University Hospital Würzburg)
Document: Protocol
Version: #2.0
Draft date: 01-20-2021
Number of pages: 53
| Title | Circulating Multiple Myeloma Cells (CMMCs) Assay as a Non-Invasive tool for Minimal Residual Disease (MRD) Assessment in peripheral blood: a comparative study with bone marrow MRD |
| Acronym | CMMC-ANIMA-02 |
| PI | Prof. Dr. Hermann Einsele (Department of Medicine II, University Hospital Würzburg) |
| Sponsor | University Hospital Würzburg |
| Central Laboratory | Prof. Dr. Dr. Andreas Beilhack Laboratory, (Department of Medicine II, University Hospital Würzburg) |
| Collaborator | Menarini Silicon Biosystems SpA, BO Italy |
| Collaborator Clinical Project Leader | Dr. Delphine Chabut Global Medical Affairs Head Menarini Silicon Biosystems S.p.A. Via Giuseppe di Vittorio 21/B3, I-40013 Castel Maggiore (BO) Italia E-mail: dchabut@menarini.ch |
| Collaborator Medical Study Manager | Dr. Francesco Picardo Medical Affairs Manager Menarini Silicon Biosystems S.p.A. Via Giuseppe di Vittorio 21/B3, I-40013 Castel Maggiore (BO) Italia E-mail: fpicardo@siliconbiosystems.com |
| Background | The emergence of several new effective drugs over the recent past dramatically improved patient outcomes in Multiple Myeloma (MM), prolonging the median survival by 4 years and more [1, 2]. Complete response (CR) rates have increased in parallel, as well as the need to develop more sensitive methods to define deeper responses and monitor minimal residual disease (MRD). Minimal Residual Disease (MRD) refers to the small number of cancer cells that remain in the body after treatment. In multiple myeloma, MRD detection is crucial for assessing the depth of response to treatment and predicting patient outcomes. Furthermore, MRD assessment is of paramount importance for future prognosis, treatment monitoring, and MRD-driven treatment strategies. Measurement of MRD in bone marrow by both next-generation sequencing (NGS) of variable diversity joining (V(D)J) rearrangements or next-generation flow cytometry (NGF) is highly predictive of survival in MM [3,4] and may therefore represent a biomarker to adapt treatment strategies [5,6]. However, serial assessments of MRD involve repeated sampling, which implies the invasiveness and the risks of repeated BM aspirations. A different way of capturing tumor heterogeneity and potentially decide upon treatment over the course of time in a minimal invasive method in MM patients may be the use of liquid biopsies from peripheral blood. Menarini Silicon Biosystems developed an automated assay to enumerate and characterize Circulating Multiple Myeloma Cells (CMMCs) from peripheral blood of patients with plasma cell disorders. Briefly, a sample of 10 ml peripheral blood is collected in the CellRescue, a dedicated tube that preserves CMMC stabilizing CD138 expression at room temperature for 120 hours. A 4 ml aliquot is placed in the Celltracks Autoprep for automated sample preparation which includes the addition of anti-CD138 ferrofluid conjugated (capture antibody) and anti-CD38 (detection antibody), DAPI and anti-CD45/CD19 (exclusion antibody). Then, the sample is transferred to Celltracks Analyzer II where a proprietary software will provide to the operator a gallery of images of “events” to be reviewed. An event is then classified as CMMC if is CD38+, DAPI+, CD45/CD19-. The results will be provided as “CMMC/4ml”. [7] So far, no peripheral blood assay to evaluate MRD has been validated. Both NGS and Euroflow methods in blood have shown low sensitivity with respectively, 44% and 40% of false negative in respect of bone marrow assessment. [8,9] CMMC assay potentially can detect down to 1 cell/4 ml, equivalent approximately to a sensitivity of 1 x 10-7 cell, higher than NGS (10-6) and NGF (10-6). Thus, our aim is to compare the CMMC assay performance in blood towards Euroflow NGF (mandatory) and Adaptive Clonoseq (optional) methods in bone marrow which are considered the reference standard for MRD assessment. |
| Objectives | Primary Objective: To contribute to set up a pooled dataset, with multiple sources, aimed to:
Secondary Objectives:
Exploratory Objectives:
|
| Collaboration design and needed data | The PB sample for CMMC enumeration is obtained within 3 days of BM collection for MRD assessment, if possible before BM aspiration to avoid the potential effects of the bone marrow procedure on the peripheral blood samples. EuroFlow data (mandatory), ClonoSEQ data (optional), mass spectrometry data (optional), ctDNA/cmmDNA data (optional) and CTCs (optional) will be collected at baseline and at first MRD assessment. Intermediate and final reports on data analyses and other specific analyses conducted at Fraunhofer ITEM and BZKF sites will be shared between parties. EuroFlow will be performed at Würzburg University Hospital when MRD and CTCs will be assessed. Mass spectrometry will be performed at Würzburg University Hospital when MRD will be assessed. ctDNA/cmmDNA analysis will be performed at Augsburg University Hospital when MRD will be assessed. CMMC enumeration using CellSearch system will be performed at Systemic Cancer Progression Laboratory (SCPL) of University of Regensburg at the specified points in time (see fig.1). CMMC isolation and single cell processing or archiving of the samples in glycerol will be performed at Fraunhofer ITEM Regensburg. |
| Inclusion Criteria |
|
| Methods | 200 patients including NDMM and RRMM patients will be enrolled into the CMMC-ANIMA-02 protocol. Patients assessed for MRD with BM aspirate analyzed with NGF EuroFlow (mandatory) and clonoSEQ (optional) assay will undergo additional PB sampling of 10 ml in CellRescue tubes and 27 ml in EDTA tubes within +3 days from BM aspiration, preferably before BM aspiration and will be included in CMMC-ANIMA analysis as per primary objective of CMMC-ANIMA-02. PB samples for CMMCs analyses will be analyzed in the SCPL, University of Regensburg, with CMMCs assay in conjunction with CellSearch System. CellSearch image galleries will be provided to MSB for blinded central analysis, further research analysis and cut off definition. In case of discrepancy, an arbiter will decide the effective value of the CMMC enumeration. After completion of the CellSearch™ CMMC test, the enriched cells will be recovered and stored in glycerol at -20°C or isolated for single cell whole genome amplification.
As detailed in the contract with Fraunhofer ITEM-Regensburg, the following selection criteria for subsequent cell isolation and single cell whole genome amplification (WGA) of CMMCs will be applied:
Samples with less than 5 cells will be considered unsuited for cell isolation and will not be processed further. Cells will be stored for no longer than 5 years from study completion. Detection of paraprotein by mass spectrometry in PB and NGF CTC assays, will be performed at Würzburg University Hospital according to standardized protocols when MRD will be assessed. Detection of ctDNA/cmmDNA in PB will be performed by CAPP-Seq at Augsburg University Hospital according to standardized methods when MRD will be assessed.
|
| Full data set Endpoints | Data collected from this CMMC-ANIMA-02 will be pooled with other sources to determine the following endpoints:
|
| Sample Size |
|
| Sites | Partner Sites Bayerisches Zentrum für Krebsforschung (BZKF): University Hospital Würzburg University Hospital, TU Munich University Hospital Augsburg University Hospital Regensburg University Hospital Erlangen University Hospital, LMU Munich University of Regensburg Fraunhofer ITEM-Regensburg |
| Study duration | up to the recruitment of 200 patients, maximum duration 2 years |
| Statistical Analysis | Data results of overall and BZKF/Fraunhofer specific analysis will be shared between parties. The comparison between CMMC assay and BM-MRD will be assessed as follows:
Furthermore, correlation among CMMC number with BM% plasma cell infiltration, M spike level and K/L ratio measured within 3 days before or after PB sampling will also be evaluated. Statistical analyses for exploratory endpoints including mass spectrometry, ctDNA/cmmDNA and NGF-CTCs will be performed based on individual requirements primarily interrogating
|
- Fortgeschrittene diagnostische Technologien für den hochempfindlichen Nachweis von malignen Plasmazellen im Knochenmark und peripheren Blut bei multiplem Myelom.
- Vorhersage des Therapieansprechens und des Krankheitsverlaufs durch Bewertung des Phänotyps normaler und maligner Plasmazellen sowie ihrer Interaktion mit der Mikroumgebung des Tumors bei multiplem Myelom.
- Prognostische Bedeutung von zirkulierenden Tumorplasmazellen bei multiplem Myelom.
- 3D-Patienten-In-vitro-Modelle zur Prüfung und Validierung der Wirksamkeit von Therapien mit dem Ziel, personalisierte Behandlungsstrategien bei multiplem Myelom zu verbessern.
- Die Implementierung eines starken Netzwerks, das fortschrittliche 3D-Patientensysteme, innovative Plattformen für die Untersuchung von Immuntherapien und modernste Analysetechnologien kombiniert und das einzigartige Fachwissen und die Ressourcen verschiedener BZKF-Zentren zusammenführt, unterstützt durch die LT OMICS, LT Präklinische Modelle, LT Zelluläre Immuntherapien und die BZKF MM-Studiengruppe.
- Vernetzung des BZKF-Zentrums mit Industriepartnern zur Validierung und Implementierung neuer diagnostischer Technologien für das Multiple Myelom. Derzeit besteht im Rahmen des BZKF eine aktive Kooperation mit der Firma Menarini Silicon Biosystems zum Vergleich verschiedener diagnostischer Technologien in Knochenmark und peripherem Blut bei Patienten mit Multiplem Myelom.
Etablierung einer BZKF-Biobank-MM mit Zielen:
- Analyse zur Bedeutung von Elotuzumab bei der Zusammensetzung des KM-Mikromileus
- Verständnis in der Zusammensetzung der B-Zellpopulationen in Knochenmark bei erreichter MRD– ve CR
- Vergleich von MRD-Techniken: NGF versus NGS
- Analysen zur Expressionsdauer des Zielantigens SLAMF-7
- Einsatz einer gegen BCMA gerichteten Therapie mit CAR T-Zellen in der Hochrisisko-Myelom-erkrankung als Komponente der Erstlinientherapie
- Verständnis der Persistenz von Resistenzmechanismen gegen CARTs
Weitere Studiengruppen
- Akute Myeloische Leukämie (AML)
- Cancer of Unknown Primary (CUP)
- Endokrine und Neuroendokrine Tumoren
- Kopf-Hals-Tumoren
- Leberkarzinom
- Lungentumoren
- Lymphom
- Malignes Melanom
- Mammakarzinom
- Ovarialkarzinom
- Pankreaskarzinom
- Primäre und sekundäre maligne Hirntumoren
- Prostatakarzinom
- R/R ALL
- Urothelkarzinom
- Weichteilsarkome
- ZNS-Tumoren bei Kindern und Jugendlichen