GDF-15-Blockade: Ein Türöffner für die Immuntherapie
Erste klinische in Nature publizierte Studie mit dem anti-GDF-15-Antikörper Visugromab in Kombination mit dem Immun-Checkpoint-Inhibitor Nivolumab bei fortgeschrittenem Krebs bestätigt den Erfolg der Forschung „from bench to bedside“. Wichtige Vorarbeiten leistete die Arbeitsgruppe von Prof. Jörg Wischhusen am Uniklinikum Würzburg (UKW) mit der Erkenntnis, dass der Wachstums- und Differenzierungsfaktor 15 (GDF-15) die Wirkung von Immuntherapien wie anti-PD-1 hemmt, mit dem Konzept zur Verbesserung der Immuninfiltration in Tumore durch GDF-15-Blockade sowie mit der Entwicklung und Patentierung von anti-GDF-15-Antikörpern.
Würzburg. Eigentlich sollen Immun-Checkpoint-Moleküle die Aktivität des Immunsystems regulieren. Die speziellen Proteine auf der Oberfläche von Immunzellen wirken dabei oft als Bremse, damit das Immunsystem nicht versehentlich gesunde Zellen angreift. Bestimmte Tumorzellen können diese Immun-Checkpoints jedoch ausnutzen, um eine Immunantwort gegen sich selbst zu verhindern. Ein bekanntes Immun-Checkpoint-Molekül ist PD-1, kurz für Programmed Cell Death 1. Bindet der von vielen Tumoren exprimierte Ligand PD-L1 an diesen Rezeptor, wird die Immunzelle regelrecht entwaffnet. Krebsimmuntherapien, die diese Immun-Checkpoint-Moleküle mit Antikörpern blockieren, haben die Behandlung vieler Krebsarten verbessert. Allerdings spricht nur eine Minderheit der Patientinnen und Patienten auf diese Immuntherapie an. Ein Grund dafür sind bestimmte von Tumorzellen produzierte, lösliche und zellgebundene immunsuppressive Faktoren. Ein Beispiel hierfür ist GDF-15.
GDF-15-Blockade verstärkt anti-PD-1- Immuntherapie
Dass und wie der in vielen soliden Tumoren stark überexprimierte Wachstums- und Differenzierungsfaktor GDF-15 (Growth/Differentiation Factor 15) effektive Immunantworten gegen Tumore verhindert, zeigten die Universitätsmedizin Würzburg und ihr Spin-Off CatalYm im vergangenen Jahr erstmals im Wissenschaftsjournal Nature Communications. Die tumorimmunologische Arbeitsgruppe von Prof. Dr. Jörg Wischhusen an der Frauenklinik des Universitätsklinikums Würzburg (UKW) konnte in präklinischen Modellen demonstrieren, dass eine Blockade von GDF-15 die etablierte Anti-PD-1-vermittelte Immuntherapie verstärkt. Auch die zur GDF-15-Blockade eingesetzten Antikörper wurden in Würzburg entwickelt. Die entsprechenden Patente wurden von der Julius-Maximilians-Universität an die Ausgründung CatalYm GmbH 2016 auslizenziert, die inzwischen ihren Sitz in München hat und seitdem rund 250 Millionen Euro an Venture-Kapital einwerben konnte.
Validierung der präklinischen Untersuchung in klinischer Studie
Die Erkenntnis, dass GDF-15 die Einwanderung von Immunzellen in das Tumormikromilieu und damit den Erfolg von Immuntherapien verhindert, und das daraus abgeleitete Konzept der GDF-15-Blockade wurden nun in einer klinischen Phase-1/2a-Studie validiert und die Daten in der Fachzeitschrift Nature veröffentlicht. Die Translation erfolgte durch CatalYm, unterstützt von einem Konsortium klinischer Studienzentren, darunter das von Dr. Maria-Elisabeth Göbeler und Professor Ralf Bargou geleitete Interdisziplinäre Studienzentrum am Comprehensive Cancer Center Mainfranken (CCC MF) mit der Early Clinical Trial Unit (ECTU).
In der sogenannten GDFATHER-1/2a-Studie (NCT04725474) wurden Patientinnen und Patienten mit fortgeschrittenen Krebserkrankungen, die auf etablierte Therapien inklusive anti-PD1 Therapien nicht mehr ansprachen, mit dem neutralisierenden Anti-GDF-15-Antikörper Visugromab in Kombination mit dem Anti-PD-1-Antikörper Nivolumab behandelt. Zwei Krebsarten, bei denen GDF-15 besonders häufig zu einer schwächeren Immunantwort führt, sind nicht-kleinzelliger Lungenkrebs und Blasenkrebs. Das Studienteam beobachtete bei einigen der eigentlich austherapierten Patientinnen und Patienten eine außergewöhnliche Dauer und Tiefe des Ansprechens. In einigen Fällen kam es sogar zu einem vollständigen Tumorrückgang - „komplette Remission“. Zudem erwies sich die Therapie als sehr gut verträglich.
Hoffnungsvolles Konzept zur Behandlung solider Tumore
In Übereinstimmung mit den präklinischen Daten wurden vermehrt aktivierte, tumorinfiltrierende Immunzellen nachgewiesen. „Die Blockade von GDF-15 ist damit ein vielversprechender neuer Ansatz, um die Resistenz gegen Immun-Checkpoint-Inhibition bei Krebs zu überwinden“, freut sich Jörg Wischhusen. „Da die Studienergebnisse unsere wissenschaftlichen Vorarbeiten voll bestätigen, ist dies ein Musterbeispiel für eine erfolgreiche Translation ‚from bench to bedside‘.“
Entscheidend für den Erfolg der Studie waren laut Wischhusen das exzellente klinische Entwicklungs-Team der CatalYm GmbH um Chief Medical Officer Prof. Dr. Eugen Leo, die Biomarkerspezialistin Dr. Kathrin Klar und die Leiterin Clinical Operations Dr. Petra Fettes sowie die mitwirkenden Studienzentren, die mit großem Engagement die Studienteilnehmerinnen und -teilnehmer rekrutierten. Als Lead Investigator konnte mit Ignacio Melero von der Universidad de Navarra einer der international renommiertesten Spezialisten für Tumorimmuntherapie gewonnen werden, der die klinische Umsetzung „mit höchster Kompetenz und ansteckendem Enthusiasmus begleitet hat“, so Wischhusen. Insgesamt waren 76 Autorinnen und Autoren an der Studie beteiligt, für Würzburg neben Jörg Wischhusen u.a. Maria-Elisabeth Goebeler und Cyrus Sayehli als Principal Investigators der Studie und Ralf Bargou als Mitglied des Advisory Boards.
Wirkmechanismen noch besser verstehen und in früheren Tumorstadien testen
Wie geht es weiter? „Wissenschaftlich wäre es wünschenswert, den Wirkmechanismus noch besser zu verstehen. Bisher wissen wir noch nicht, warum manche Patientinnen und Patienten auf die Kombinationstherapie ansprechen und andere nicht“, so Wischhusen. Klinisch soll die neue Therapie nun in kontrollierten randomisierten Studien bei Patientinnen und Patienten mit nicht-kleinzelligem Lungenkarzinom in früheren Tumorstadien in Kombination mit einer Immunchemotherapie getestet werden. Dazu die Leiterin der interdisziplinären ECTU Maria-Elisabeth Goebeler: „Der Start für diese Phase II Studie ist für das erste Quartal 2025 zu erwarten. Wir freuen uns, dass die ECTU des UKW diese attraktive Studie für unsere Patientinnen und Patienten anbieten wird.“ Bargou, Direktor des CCC Mainfranken, spricht Visugromab viel Potential für zukünftige Behandlungsansätze zu und meint: „Grundsätzlich könnte Visugromab auch die Wirksamkeit anderer Immuntherapien verbessern, etwa mit CAR-T-Zellen oder bispezifischen Antikörpern, verbessern. Zudem ist davon auszugehen, dass der Antikörper auch bei anderen Tumorentitäten wirksam ist.“
Publikation: Melero, I., de Miguel Luken, M., de Velasco, G. et al. Neutralizing GDF-15 can overcome anti-PD-1 and anti-PD-L1 resistance in solid tumours. Nature (2024). https://doi.org/10.1038/s41586-024-08305-z
Pressemeldung von CatalYm: CatalYm Highlights Visugromab’s Potential to Treat Cachexia in Cancer Patients at International SCWD Conference
Pressemeldung vom 20. Juli 2023 anlässlich der Publikation in Nature Communications zur Wirkung des Zytokins GDF-15 auf die LFA-1/Zelladhäsionsachse bei Tumor-assoziierten T Zellen.
Text: Kirstin Linkamp / UKW
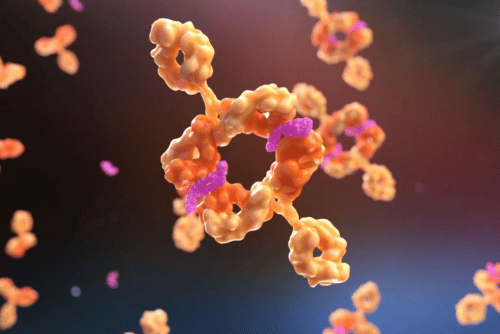
Bild: Der Antikörper Visugromab (dargestellt in pink) blockiert gezielt den Wachstums- und Differenzierungsfaktor 15 (GDF-15, dargestellt in orange). Durch die Neutralisierung von GDF-15 kann Visugromab das Immunsystem dabei unterstützen, Tumore effektiver anzugreifen und Resistenzen gegen Immuntherapien zu überwinden. © CatalYm